Die Mistel in der adjuvanten Tumortherapie
Einführung
Biologische Wirkungen
Zytotoxizität
Immunmodulation
DNA-Stabilisierung
Wirkungen relevanter Inhaltsstoffe
Mistel-Lektine
Viscotoxine
Oligo- und Polysaccharide
Klinische Anwendung
Literatur
Tai Shimano besuchte Shunryu Suzuki: "Wie geht es Dir so?"
Suzuki antwortete: "Sie haben einen neuen Namen für mich gefunden: Krebs!"
Einführung

Der Gebrauch von Misteln in der Magie und Medizin hat eine mehr als 2.000-jährige Tradition. Ein Räuchern von Häusern, Ställen, Tieren und Menschen mit Misteln und aromatischen Pflanzen sollte vor Blitzschlag, Verhexung und Alpträumen schützen Als wichtige heilkundliche Indikation der "nicht zur Erde fallenden" Mistel galt die Behandlung der Epilepsie, aber auch Menstruationsbeschwerden sowie Herz- und Lebererkrankungen. Heute ist die Behandlung von Tumorpatienten mit Extrakten aus Viscum album L. (VA-E), die auf Empfehlungen von Rudolf Steiner (1920) zurückgeht, eine der am weitesten verbreiteten Formen der unkonventionellen Therapie in der Betreuung von Tumorpatienten in Europa. Unbestritten in der wissenschaftlichen Auseinandersetzung über die klinische Bedeutung von VA-E in der adjuvanten Tumortherapie ist einzig, dass die Mistel polarisiert: Strikte Ablehnung auf der einen Seite, kritische Akzeptanz auf der anderen Seite.
Ist diese Therapieform auch wirksam, profitieren Tumorpatienten von dieser Therapie? Tatsächlich lassen sich nach Applikation von VA-E reproduzierbare Reaktionen (Wirkungen) beobachten, die aber nicht notwendigerweise gleichbedeutend mit Wirksamkeit sein müssen.
Als wichtige Wirkungen der VA-E lassen sich experimentell bestätigen: (1) die Auslösung eines gesteuerten "Selbstmord-Programmes" der Zielzelle (Apoptose), (2) die Modulation immunologischer Reaktionen, (3) der Schutz der DNA gegenüber Chemotherapeutika (Übersicht bei [Büssing, 1997, 1998, 1999, 2000]). Während sich die zytotoxischen Wirkungen der VA-E sowohl den Mistel-Lektinen (ML) und den Viscotoxinen zurechnen lassen, beschränken sich die immunmodulierenden Wirkungen nicht nur auf die ML sondern werden auch durch Poly- und Oligosaccharide (z.B. Rhamnogalacturonan), Viscotoxine und andere, bisher wenig charakterisierte Komponenten induziert. Die Bedeutung der Flavonoide (u.a. Rhamnazin und Quercetinderivate), Phenylpropanoide (u.a. Anissäure, Kaffeesäure, Ferulasäure, Syringasäure, Vanillinsäure), Phytosterole, Triterpene, Polyalkohole (u.a. Inositolderivate), biogene Amide, freie Aminosäuren und Vitamin C für die Wirkung der VA-E ist noch nicht geklärt. Im Folgenden sollen die pharmakologischen Grundlagen der Misteltherapie und ihre mögliche Bedeutung in der Tumorbehandlung dargestellt werden.
Biologische Wirkungen
Zytotoxizität
VA-E lösen in Tumorzellen, aber auch in normalen Zellen einen gerichteten Zelltod (Apoptose) aus, wobei die sich rascher vermehrenden Tumorzellen deutlich sensibler sind als differenzierte Zellen. Im Tumor unterliegen die einzelnen Zellen in der Regel nicht mehr der "Kontrolle" durch den Organismus in dem Sinne, dass sie gegenüber den physiologische Zelltod-Signalen unempfänglich sind, oder aber vermehrten Wachstums-Stimuli ausgesetzt sind. Die Tumorzellen haben sich "emanzipiert", sind "unabhängig geworden". Eine Behandlungsmodalität, die die Apoptose wieder auslösen könnte, wäre also durchaus ein rationales Konzept.
Das Apoptose-induzierende Potential von VA-E unterschiedlicher Wirtsbäume korrelierte mit dem ML-Gehalt, wobei diese Korrelation jedoch nicht für alle Präparate bzw. Herstellungen gefunden werden konnte. In einer Vielzahl von Experimenten mit Tumor-tragenden Mäusen konnten eindrucksvolle Hemmungen des Wachstums der Tumoren und/oder verlängerte Überlebenszeiten nach Injektion von VA-E beobachtet werden.
Immunmodulation
Nach Gabe von Mistel-Extrakten lassen sich verschiedene immunologische Reaktionen beobachten, die in einem hohem Maße von der Art der Applikation abhängig sind.
Bei der subkutanen Gabe von VA-E kommt es innerhalb eines Beobachtungszeitraumes von 4-6 Wochen zur Induktion von Akut-Phase-Proteinen, natürlichen Killer (NK)- und T-Zellen sowie B-Zellen mit Produktion von anti-ML-Antikörpern und pro-inflammatorischen Zytokinen und zur Freisetzung von b
-Endorphin. Auch bei längerfristiger Therapie mit VA-E und Dosissteigerung in Abhängigkeit von den induzierten Lokalreaktionen kommt es zur signifikanten Vermehrung von Lymphozyten, insbesondere der NK-Zellen. Eine Immunsuppression im Sinne einer zahlenmäßigen Reduktion definierter Subpopulationen konnte auch bei deutlicher Dosissteigerung im gesamten Beobachtungszeitraum nicht beobachtet werden.
Die intravenöse Applikation hoch-dosierter VA-E führte zu keinerlei Beeinträchtigung der Blutbildung, wohl aber zur vorübergehenden Vermehrung jugendlicher Monozyten und Granulozyten 24 h nach der Infusion. Bei Patientinnen mit zervikalem Carcinoma in situ kam es nach einmaliger perioperativer intravenöser Gabe eines fermentierten VA-E zur Steigerung der funktionellen Kompetenz der Granulozyten (Escherichia coli-induzierter oxidativer Burst) (Büssing, Stein, Gmeindl; unveröffentlichte Beobachtungen).
Auch die intrapleurale Gabe von VA-E bei malignen Pleura-Ergüssen führte zur Eliminierung der Tumor-Zellen mit nachfolgender Austrocknung des Pleura-Ergusses; dies ging einher mit einer Vermehrung von Eosinophilen, T-Helfer/Induktor-Lymphozyten und NK-Zellen im Exsudat bzw. einer passageren Vermehrung von Makrophagen und Eosinophilen in der Responder-Gruppe, die sich bei den Non-Respondern nicht beobachten ließ.
DNA-Stabilisierung
Neben den zytotoxischen Wirkungen der VA-E lassen sich DNA-stabilisierende Wirkungen nachweisen. So konnte gezeigt werden, dass durch VA-E sowohl spontane Schwesterchromatid-Austausch-induzierende DNA-Schäden als durch das Alkylanz Cyclophosphamid hervorgerufene Schäden gehemmt werden und die durch Cyclophosphamid unterdrückte Aktivierungsmarker-Expression auf Immunzellen zu verbessern war. Diese Wirkungen ließen sich nur durch den Gesamtextrakt nicht jedoch durch definierter Inhaltsstoffe, wie den ML oder den Viskotoxinen, erzielen. Auch ließen sich die schützenden Wirkungen nicht in Leukämie-Zellen oder im Tierversuch nachweisen; die gleichzeitige Zugabe von Cyclophosphamid und Mistel-Extrakt führte hier zu einer stärkeren Abnahme der Zahl leukämischer Zellen bzw. der Lungenmetastasen als Chemotherapie alleine.
Im Maus-Modell konnten die protektiven Wirkungen von VA-E gegenüber Cyclophosphamid oder Bestrahlung bestätigt werden, wobei hier sowohl ein längeres Überleben der Mäuse als auch eine Reduktion der induzierten Leukozytopenie erzielt wurde.
Da sowohl Tumorpatienten als auch Patienten mit präkanzerösen Läsionen in Abhängigkeit vom Tumorstadium signifikant höhere spontane und induziert Schwesterchromatid-Austausch-induzierende DNA-Schäden aufweisen als gesunder Kontrollen, könnte sich daher eine Besserung der chromosomalen Destabilisierung bei den Tumorpatienten möglicherweise als günstig für die Entwicklung bzw. Verlauf der Erkrankung auswirken. Dies wird zur Zeit in einer randomisierten klinischen Studie am Allgemeinen Krankenhaus Wien überprüft.
Wirkungen relevanter Inhaltsstoffe
Mistel-Lektine
Die toxischen Lektine aus Viscum album hemmen in höheren Konzentrationen die Eiweißsynthese sowohl von Tumorzellen als auch von normalen Zellen. Diese Hemmung der Eiweißsynthese führt zum gerichteten Zelltod (Apoptose). Die ML führen im Reagenzglas aber nicht nur zum Zelltod, einige Lymphozyten überleben. Diese Zellen zeigen eine signifikante Heraufregulation eines Moleküls (Fas-Ligand; CD95L), das in Fas+ Tumorzellen wiederum die Apoptose auslösen kann. Da die zytotoxische Potenz der ML bei sowohl bei der subkutanen als auch bei der intravenösen Applikation aufgrund der Bildung blockierender anti-ML-Antikörper, während der Misteltherapie und der Hemmung durch definierte Serumbestandteile nicht zum Tragen kommt, wäre zu erklären, wieso es bei Tumor-ferner Gabe von VA-E dennoch zu einer anti-Tumor-Antwort sekundär aktivierter Immunzellen kommen kann. Eine klinisch relevante ML-Zytotoxizität ist vornehmlich bei der direkten Injektion von VA-E in den Tumor zu erwarten. In der Tat konnte gezeigt werden, dass bei dieser Applikation das Tumorvolumen effizient zu reduzieren ist.
Im Reagenzglas kommt es nach Inkubation von Tumorzellen oder normalen Zellen zur Freisetzung bestimmter Zytokine, insbesondere Tumor-Nekrose-Faktor-a
, Interleukin-1 und -6 als auch zum Zelltod. Im Tiermodell hingegen kommt es zur Aktivierung bestimmter Immunzellen. So beschrieben Hajto und Mitarbeiter nach Injektion von ML I eine verbesserte Zahl und Aktivität natürlicher Killer-Zellen. An Mäusen beobachteten Beuth und Mitarbeiter nach Applikation von ML I in 1 ng/kg Körpergewicht (oder einem auf ML I-normierten VA-E) eine signifikante Vermehrung von Peritoneal-Makrophagen, peripheren Monozyten, aktivierten Lymphozyten sowie Thymozyten. Untersuchungen zur Applikation von ML I in Konzentrationen > 1 ng/kg Körpergewicht liegen für Tumorpatienten bisher nicht vor. Bei sukzessiver Dosissteigerung ML-reicher VA-E werden jedoch tatsächlich ML-Konzentrationen erreicht, die 1 ng/kg Körpergewicht deutlich übersteigen, ohne dass es zur Depletion immunkompetenter Zellen kam.
Viscotoxine
Die Viscotoxine gehören zur Familie der a - und b -Thionine, einer Gruppe basischer, Cystein-reicher Eiweiße, die vornehmlich im Endosperm verschiedener Gramineae gefunden werden. In Tumorzellen und Lymphozyten kommt es nach Inkubation mit den Viscotoxinen zur Zerstörung der Zellmembran im Sinne eines nekrotischen Zelltodes, während die physiologische Aufgabe der Granulozyten und Monozyten, das Erkennen und Beseitigen von Keimen, verbessert wird. So konnte kürzlich von Stein und Mitarbeitern gezeigt werden, dass die Viskotoxine sowohl die Phagozytose opsonisierter Escherichia coli und CD8+ T-Zellen als auch den oxidativen Burst durch neutrophile Granulozyten verstärken. Eine mögliche Bedeutung dieser Beobachtungen für die klinische Anwendung wird zur Zeit in einer kontrollierten Studie geprüft. muß geprüft werden.
Oligo- und Polysaccharide
Verschiedene Zuckerverbindungen aus Viscum album aktivieren natürliche Killer-Zellen und Monozyten/Makrophagen, stimulieren die Freisetzung von Interferon-g
bzw. Tumor-Nekrose-Faktor-a
aus T-Helfer/Induktor-Lymphozyten und eine "Brückenbildung" zwischen NK-Zellen und Tumorzellen. Eine Stimulation von T-Helfer/Induktor-Lymphozyten und Freisetzung von Inerleukin-6 und Interferon-g
konnte durch Inkubation humaner Lymphozyten mit Polysacchariden aus Mistelbeeren (Arabinogalaktan) bestätigt werden.
Klinische Anwendung
Nach der subkutanen Applikation der VA-E setzt sich das Immunsystem der Patienten mit dem Antigen "Mistel" auseinander. Hierbei kommt es zu einer Vermehrung immunkompetenter Zellen und Freisetzung bestimmter Mediatoren, wobei nicht eindeutig geklärt ist, ob diese Reaktionen auch mit einer effizienten anti-Tumor-Antwort einhergehen. Auftretende Lokalreaktionen (Rötung, Schwellung und Juckreiz) an der Injektionsstelle und Anstieg der Körpertemperatur dürfen nicht als allergische Reaktion oder als Ausdruck einer "Arzneimittel-Krankheit" missinterpretiert werden. Diese Reaktionen zeigen an, dass sich das Immunsystem mit dem VA-E ("Fremd") auseinandersetzt, und können zur Steuerung der Therapie genutzt werden. Eine therapeutische Intervention ist hierbei in der Regel nicht nötig, da auch starke Lokalreaktionen innerhalb von wenigen Tagen abklingen und man anschließend mit einer geringeren Dosis fortfahren kann.
Diverse Studien, sowohl retrospektiv als auch prospektiv geführte, weisen darauf hin, dass Patienten, die neben der konventionellen Tumortherapie mit VA-E behandelt worden sind, länger und besser leben (Übersicht bei [Kiene, 1996]). Man mag dagegenhalten, dass diese Untersuchungen in den meisten Fällen methodologisch eher bescheiden sind und ein Überlebensvorteil demnach zu relativieren ist. Dennoch: Auch in der Tumorambulanz des Gemeinschaftskrankenhauses Herdecke weisen bisher unveröffentlichte statistische Auswertungen von Stumpf und Mitarbeitern darauf hin, dass zum Beispiel Patienten mit malignen Melanomen, die mit VA-E behandelt worden sind, deutlich länger leben als die konventionell behandelten Patienten (Stumpf et al., zur Veröffentlichung eingereicht). Zudem konnte bei Patienten mit metastasierten Tumoren immer wieder beobachtet werden, dass nach Aussetzen der Misteltherapie jahrelang "ruhige" Metastasen rasch wuchsen (Abbildung 1), was dafür spricht, dass eine Stimulation der "Immunüberwachung" durch VA-E sinnvoll sein kann.
|
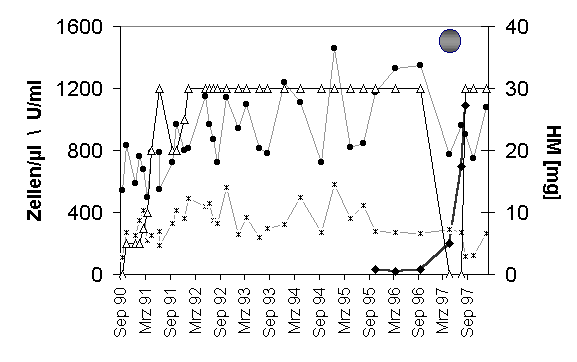
|
Abbildung 1: Entwicklung der Zahl CD4+ T-Helfer/Induktor-Zellen (l
) und CD16+/CD56+ NK-Zellen (x) in Abhängigkeit von der applizierten Konzentration des VA-E (D
, HM: Helixor M, 2x wöchentlich s.c.) bei einer von Herrn Priv.-Doz. Dr. med. M. Schietzel, Gemeinschaftskrankenhaus Herdecke, betreuten Patientin (MG/w/1943) mit metastasiertem Brustkrebs. Nach Aussetzen der VA-E-Injektionen seitens der Patientin stieg der Tumormarker (u
, Ca 15-3) an und die seit Jahren nicht mehr gewachsenen Metastasen nahmen rasch an Größe zu (¦
), so dass die Patientin Chemotherapie-pflichtig wurde und ein Jahr später an einer Lungenentzündung verstarb. |
Auch wenn ein allgemein akzeptierter Wirksamkeitsnachweis in einer randomisierten, Plazebo-kontrollierten Studie (so sie denn tatsächlich sinnvoll und möglich sein sollte) bisher fehlt, läßt sich nicht leugnen, dass sich die Patienten nach den VA-E-Injektionen in der Regel deutlich besser, motivierter fühlen. Dies mag mit bedingt sein durch eine nach Injektion von VA-E beobachtete Ausschüttung von b
-Endorphin, aber auch durch die Hoffnung, nicht hilflos einem unvermeidlichen Schicksal ausgeliefert zu sein, mit der selbstständig durchgeführten Injektion wieder Verantwortung für sich zu übernehmen, noch nicht am Ende zu sein. Tatsächlich konnte Grossarth-Maticek [1999] nachweisen, dass die Überlebenszeit von Tumorpatienten signifikant abhängig ist von ihrer Fähigkeit sich aktiv mit ihrer Umgebung auseinanderzusetzen ("Selbstregulation"). Gerade die Patienten mit einem hohen "Selbstregulations"-Level profitierten auch signifikant von einer Therapie mit VA-E (Grossarth-Maticek, in Vorbereitung).
Aber "heilt" man mit einer ausschließlichen Misteltherapie? Richtig durchgeführt, kann sie eine wertvolle Hilfe in der Betreuung von Tumorpatienten sein (Tabelle 1); die Mistel ist jedoch sicherlich nicht das von dem römischen Historiker Gaius Plinius Secundus (23-79 n. Chr.) beschriebene allesheilende Wundermittel (omnia sanantem) [Plinius, 1991]. Eine adäquate Behandlung mit VA-E sollte jedoch nicht ausschließlich auf "den Tumor" gerichtet sein sondern die Situation des Patienten berücksichtigen: es soll ein Patient betreut werden, kein Tumor. Eine Misteltherapie kann daher wesentlicher Bestandteil eines umfassenden Therapie-Konzeptes sein. So lassen sich auch übertriebene Erwartung an "die Misteltherapie" vermeiden. Es gilt, für den betroffenen Patienten eine individuelle Therapiewahl zu treffen und deren Umsetzung auch langfristig begleitend zu kontrollieren: Nützt die gewählte Therapie - oder muss sie verändert werden? Starre Therapieschemata, die das individuelle Reaktionsvermögen nicht berücksichtigen, führen eher zu einer Verschlechterung der Qualität einer Misteltherapie.
Tabelle 1: Applikationsarten von VA-E und Reaktionsmöglichkeiten
|
Therapeutische Ziele |
|
Empfehlung |
|
Verbesserung der subjektiven Befindlichkeit und Immunmodulation |
|
Subkutane Applikation von VA-E mit intermediärer inflammatorischer Potenz |
|
Verbesserung der Verträglichkeit einer Chemotherapie bzw. Verringerung deren Nebenwirkungen |
|
Applikation von VA-E (subkutan bzw. intravenös?) mit antimutagener Wirkung aber geringer zytotoxischer Potenz |
|
Schmerzlinderung bei Knochenmetastasen |
|
Hochdosierte intravenöse Applikation von VA-E |
|
Pleurodese bei malignen Pleuraergüssen |
|
Intrapleurale Instillation hochdosierter VA-E mit hoher zytotoxischer Potenz |
|
Destruktion okkludierender Tumoren |
|
Intratumorale Applikation von VA-E mit hoher zytotoxischer Potenz |
Die Bedeutung der begleitenden Misteltherapie für die komplementäre Krebsbehandlung ist bei weitem noch nicht abzusehen. Hier könnten Fortschritte insbesondere durch unterschiedliche Applikationsarten und durch eine bessere Charakterisierung der Potenzen unterschiedlicher VA-E bei definierten Tumorarten möglich sein. Ob eine Normierung von VA-E auf einen einzelnen Inhaltsstoff oder gar dessen gentechnische Herstellung als Fortschritt angesehen werden kann, bleibt abzuwarten.
Literatur
Büssing, A. (Hrsg.): Mistletoe therapy and immunological research. Anticancer Drugs 1997; 8 (Suppl. 1), S1-S65.
Büssing, A.: Apoptose-Induktion und DNA-Stabilisierung durch Viscum album L. Forschende Komplementärmedizin 1998; 5, 164-171.
Büssing, A.: Biologische Wirkungen der Mistel. Zeitschrift für Onkologie 1999; 31, 35-43.
Büssing, A. (Hrsg.): Mistletoe. Genus Viscum. Harwood Academic Publishers, Amsterdam, 2000
Grossarth-Maticek, R.: Systemische Epidemiologie und präventive Verhaltensmedizin chronischer Erkrankungen. Walter de Gruyter Verlag, Berlin, New York, 1999.
Kiene, H.: Beurteilung klinischer Studien zur Misteltherapie. In: R. Scheer, H. Becker und P.A. Berg (Hrsg.), Grundlagen der Misteltherapie. Aktueller Stand der Forschung und klinische Anwendung, Hippokrates Verlag, Stuttgart, 1996, S. 484-496.
Plinius Secundus, G.: Naturkunde. Buch XVI. Botanik: Waldbäume. Artemis & Winkler Verlag, München, 1991, S. 155/157.



